Cicatrización cutánea asistida por láser (LASH) – laser assisted scar healing (LASH)
La fase final de toda cirugía es la sutura y su cicatriz correspondiente y, frecuentemente, ésta es la única secuela visible de una intervención.
La técnica LASH (cicatrización cutánea asistida por láser), estimula los mecanismos de reparación de la piel por efecto térmico, condicionando la calidad de la cicatrización.
Estudios experimentales en ratones comparando los resulta- dos obtenidos en heridas quirúrgicas radiadas con láser diodo 810 nm tras ser suturadas, con los obtenidos en igual tipo de heridas suturadas de manera convencional, han demostrado que se consiguen cicatrices mucho menos visibles cuando se practica el tratamiento con láser. La histología confirma, comparativamente, una notable aceleración del proceso cicatricial con modificación del TGFß (Trans- forming Growth Factor-Beta) directamente implicado en la reparación tisular, en los animales en los que la sutura fue asistida por láser.
Igualmente, el análisis tensiométrico demostró mayor resistencia a la acción de estiramiento mecánico en estas heridas. Estudios clínicos en pacientes sometidos a dermolipectomia, reducción mamaria y estiramiento facial, demuestran que al tratar con LASH una parte o una de las líneas de sutura, los análisis realizados tanto por los pacientes como por cirujanos independientes a los 8 días, 3 meses y un año, evidencian resultados más favorables para la técnica láser, Las dosis eficaces determinadas para las fluencias láser están entre 80 y 120 J/cm 2 .
La técnica LASH es simple de efectuar, reproducible, rápida y ofrece una clara evidencia de que es posible reducir considerablemente la cicatriz, logrando que ésta sea de mejor calidad y más estética.
Introducción
En el devenir profesional, cualquiera que sea la especialidad, los médicos efectúan suturas cutáneas en algún momento de su práctica. El cierre de una incisión quirúrgica como fase final de la intervención reviste gran importancia, ya que de ella dependerá a menudo la única secuela visible de la intervención que conocemos como cicatriz cutánea.
Así, la meta de la cirugía incisional es que el tejido, una vez suturado, regenere con una estructura estética y funcional óptima, de iguales características que la piel no intervenida.
Una cicatriz no debe considerarse como una parte trivial de la cirugía, pues la curación de una incisión con mala calidad puede constituir una patología invalidante y llegar a tener implicaciones como la exclusión social (1). Después de la incisión quirúrgica, la irradiación con láser en el momento de la sutura mejora las características de reparación de la herida, permitiendo evitar telangiectasias, cambios de coloración de la piel y mejorar su textura (2).
Desde que Abergel utilizó el láser de Nd:YAG de 1064 nm para la “soldadura cutánea” (3), el láser como ayuda de la cicatrización constituye un tema de interés, pues se ha observado que la combinación de suturas y láser acelera las fases de curación de las heridas, incrementando la calidad de la cicatriz y mejorando su resistencia en las pruebas de tracción, si se compara con las incisiones cerradas solo con sutura convencional (4).
Estudios clínicos recientes evidencian que aplicar la luz láser, durante el curso del proceso cicatricial, además de mejorar el aspecto final del tejido previene las complicaciones propias de la cicatrización (5-9). Basándose en los efectos terapéuticos que produce la hipertermia moderada selectiva, la técnica LASH (Laser Assisted Skin Healing), o cicatrización cutánea asistida por láser, estimula los mecanismos naturales de reparación de la piel durante la fase crítica de cierre de la herida.
Fundamentos de la cicatrización asistida por láser
(LASH)
La técnica LASH se basa en el principio de actuación térmica a nivel tisular originada por el haz particular del láser. La energía láser, al ser absorbida en el tejido produce elevación de la temperatura por lo que la extensión del área que debe calentarse y el tiempo durante el cual el calor debe mantenerse, condicionan su acción sobre la cicatrización. La energía térmica en el tejido se distribuye espacialmente en función de los parámetros del láser, pero también los coeficientes ópticos de absorción de los varios elementos de la piel influencian su comportamiento durante la interacción de la luz láser en el tejido. Entre los 750 y 900 nm del espectro lumínico es donde la absorción de la luz láser por el agua es más débil. Es en esta porción del espectro de la luz donde existe menor absorción por la oxihemoglobina y la deoxihemoglobina que además, como cromóforos (o dianas de absorción), se encuentran ampliamente distribui- dos en la piel. En base a estos postulados el espectro entre 750 y 900 nm es el más propicio para que la luz penetre en la piel y los efectos ocurran en profundidad (10)
(Fig. 1).
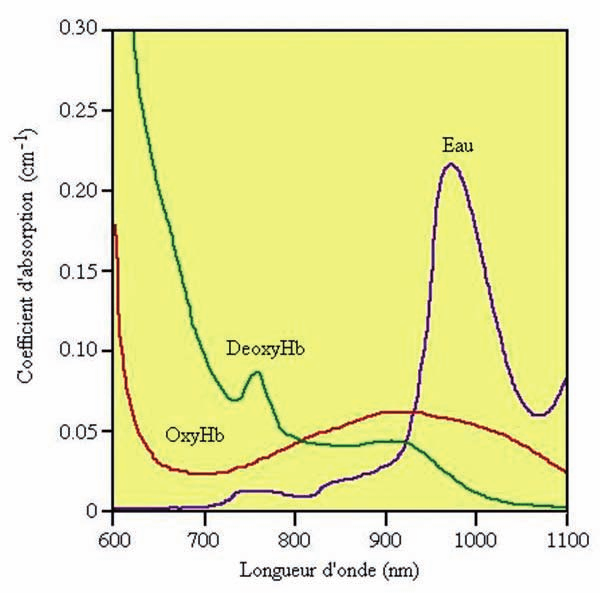
Fig. 1. Espectro de absorción de los principales cromóforos de los tejidos
biológicos. La luz láser irradiada implica un aumento moderado de la tem-
peratura tisular, activando las proteínas de estrés (HSP70) o moléculas cha-
peronas, que juegan un papel destacado en el proceso de reacción
inflamatoria que ocurre en el tejido durante de la cicatrización.
Material y método, Resultados experimentales
Presentamos nuestra experiencia acerca de trabajos preliminares conducidos en nuestros centros en 2 grupos de 25 ratones sin pelo, y en la clínica con pacientes, que han hecho posible el desarrollo de una técnica original utilizando un diodo-láser de 810 nm para asistir el pro-ceso de cicatrización cutánea y mejorar la reparación delas heridas (4).
Comparamos experimentalmente las incisiones cutáneas efectuadas con bisturí en el dorso de un grupo de 25 animales tratados con láser después de sutura intradérmica, con un grupo de igual número de animales, de iguales características, en los que se realizó únicamente la sutura de la herida sin irradiación láser. En el grupo de animales tratados con láser, los bordes de la herida se aproximaron hasta su contacto uniéndolos con un apósito adhesivo simple (Steri-strip®3-M España, SA, Madrid). En el grupo de los 25 animales testigo, seguimos el mismo proceso de incisión pero la herida se cerró mediante sutura continua intradérmica y no se empleo el láser (10).
Durante el seguimiento, las heridas tratadas con láser evolucionaron hacia cicatrices mucho menos visibles que las de los animales testigo (Fig. 2). Comparativamente, en el grupo tratado con láser el análisis histológico confirmó que se producía notable aceleración del proceso cicatricial gracias al análisis de inmunohistoquimia con anticuerpos policlorados anticolágeno tipos I y III y para definir también la fibronectina.
Los cortes histológicos se marcaron después de su inclusión en parafina con el correspondiente anticuerpo y la presencia de colágenos tipo I y II y fibronectina se cuantificó por análisis de imagen con ayuda del sistema informático Leica Qwin (Leica®, SAS, Francia). Dicho análisis mostró modificación de la presencia de las diferentes formas del TGFβ como factores de expresión propios de la cicatrización, modificados por el efecto térmico láser. También se observó, como reacción del moderado aumento de la temperatura después de la irradiación láser, la activación de las proteínas de estrés (HSP70, heat shock protein). Estas proteínas, modulan el proceso de reacción inflamatoria (11) y son necesarias durante la cicatrización, ya que su ausencia compromete notablemente el cierre de la herida (12,13).
De otra parte, el análisis tensiométrico en los animales tratados demostró mayor resistencia al estiramiento mecánico de las heridas.
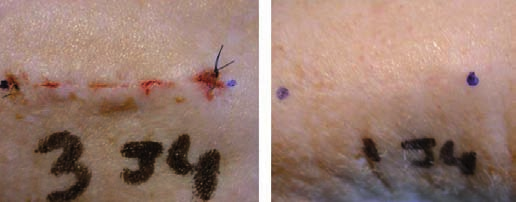
Fig. 2. Aspecto de las heridas suturadas, 4 días después de la incisión efec- tuada hasta el plano muscular. Izquierda: herida cerrada mediante sutura continua intradérmica, sin láser. Derecha: herida cerrada mediante un apósito transparente adhesivo y láser diodo 810nm.
Las TGFβ juegan un papel importante dentro del equilibrio/reparación/regeneración de la piel después de producirse una herida.
Está comunicado en la literatura que la expresión predominante de TGF-β3, en relación a TGF-β1 y a TGF-β2, permite disminuir el periodo de reparación tisular y favorece la regeneración del tejido durante las fases de la cicatrización. Obviamente, esto tiene implicaciones en la disminución del tiempo de cicatrización y en lo concerniente al aspecto, forma y estética finales de la cicatriz.
Resultados clínicos
Más recientemente, el ensayo clínico «Evaluación de una técnica original de sutura cutánea asistida por diodo- láser de 810 nm» conducido por la sociedad Ekkyo® (www.ekkyo.com), permitió evaluar una técnica original de cicatrización cutánea en pacientes cuando ésta es asistida por la luz del láser de diodo de 810 nm (2).
El tratamiento láser se realizó en pacientes con fototipos I a IV según la clasificación de Fitzpatrick, programados para intervenciones de dermolipectomía, reducción mamaria y estiramiento facial, que implican realizar cicatrices visibles y lineales. El sistema se evaluó utilizándolo al final de la intervención quirúrgica y efectuando pulsos láser inmediatamente después del cierre de la incisión quirúrgica (Fig. 3).
En cada paciente, la totalidad de la herida quirúrgica se cerró mediante sutura continua y, solamente un segmento de 8 cm de su longitud total, se trató con láser. En las intervenciones tipo estiramiento facial, realizamos tratamiento láser en un solo lado. Todos los pacientes fueron revisados durante su evolución a los 8 días, 3 meses y 1 año, mediante estricto examen visual documentado fotográficamente.
Las fotografías de las cicatrices se realizaron, siguiendo condiciones estandarizadas, durante el postoperatorio inmediato y en cada consulta realizada a los 8 días, 3 meses y 12 meses después de la cirugía. Las fotografías se analizaron por 2 examinadores independientes que desconocían el proceso de tratamiento seguido y que calificaron los resultados en una escala visual (VAS) siguiendo el modelo Vancouver modificado. Igualmente, tanto los pacientes como el cirujano que realizaron la intervención evaluaron la forma, calidad y estética de la cicatriz resultante, empleando como guía una escala visual (VAS) con graduaciones de 0 a 100 para comparar los resultados de la sutura láser con los de la sutura continua clásica.
La primera fase o estudio piloto realizado en 15 pacientes entre julio del 2006 y diciembre del 2007 y posteriormente extendido a una series de otros 8 pacientes por uno de los autores (MAT), permitió evaluar el sistema láser en cuanto a su eficacia y seguridad, determinándose como dosis eficaces de tratamiento las fluencias entre 80 y 120 J/cm 2 (Fig. 4 y 5).
El análisis estadístico empleando la prueba de Wilcoxon sobre la base de los resultados obtenidos en 11 pacientes después de 1 año de seguimiento, evidenció resultados significativos. Estadística-mente, la calificación de los cirujanos dio como resultado p = 0,046 y la de los pacientes p = 0,025. Todos los pacientes manifestaron en su valoración mayor satisfacción que la apuntada por los cirujanos, con un resultado p = 0,02. No se detectaron efectos secundarios.
Fuente – Descargar archivo completo; Soldura Cutanea
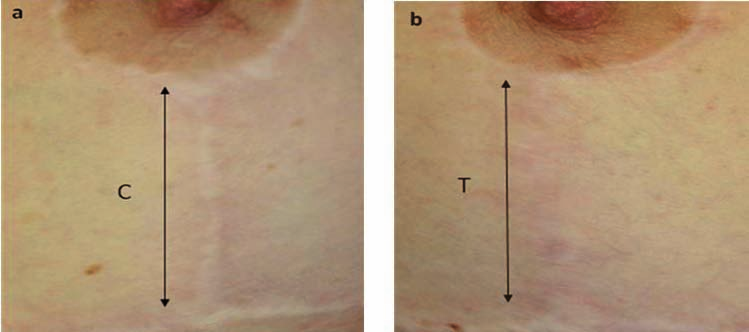
Fig. 4. Mujer de 35 años de edad; imagen 12 meses después de reducción mamaria, con cicatriz vertical A) Sin tratamiento láser. B) Tratada con láser. C es el control, no tratado con láser y T, es la sutura tratada con láser.
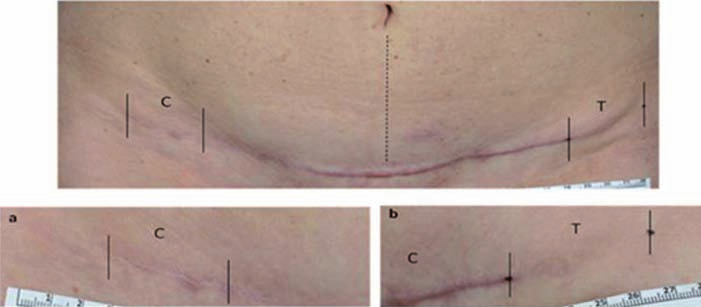
Fig. 5. Mujer de 47 años de edad; imagen 12 meses después de abdominoplastia. Los extremos corresponden a las líneas de incisión tratadas con láser, comparativamente a la parte central de la herida no tratada con el láser. A y B muestran en detalle los resultados.
En una segunda fase de la investigación, un estudio multicéntrico realizado sobre 25 pacientes entre enero y julio del 2008, los resultados fueron igualmente de alta eficacia y satisfacción.
Casos ilustrativos
Caso 1: Paciente fototipo II. Presentamos detalle de las cicatrices preauriculares bilaterales resultantes tras un mini-estiramiento del tercio inferior de la cara a los 3 meses de la cirugía.
En la figura 6A empleamos sutura clásica y observamos hipertrofia cicatricial y eritema residual. En la figura 6B la sutura se asistió con pulsos láser y presenta una cicatrización correcta. Las figuras 6 C y D presentan imágenes de la revisión al año de la cirugía; en C se evidencia desplazamiento caudal del lóbulo de la oreja, que se muestra unido en su extremo distal a la piel del cuello y en D, cicatriz asistida por láser, venos como 1año después la calidad de la cicatriz es buena.
Caso 2: Paciente fototipo III después de dermolipectomía. En la figura 7 A vemos el aspecto de la cicatriz a los 3 meses de la intervención; podemos observar las depresiones que aparecen en toda la extensión de la línea de incisión y la formación de “oreja de perro” en el extremo izquierdo. La paciente había usado tratamiento compresivo con bandas de silicona durante todo este periodo.
En la figura 7 B vemos el resultado 3 meses después de la reintervención de la cicatriz; practicamos escisión de la cicatriz, corrección de los extremos y sutura en dos planos, asistida por láser en la totalidad de la línea de sutura. Los resultados muestran una cicatriz prácticamente imperceptible en sus extremos y buen aspecto de las características y textura de la piel.
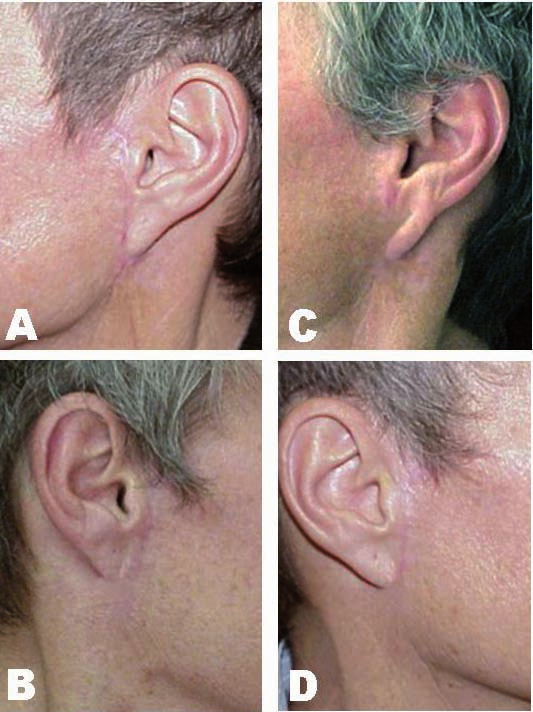
Fig. 6. Mini-estiramiento del tercio inferior facial. Paciente de 58 años de edad, fototipo II. A) y B) cicatrices preauriculares 3 meses después de la intervención. En A) se empleó sutura clásica: hipertrofia cicatricial y eritema residual. B) sutura y láser: cicatrización correcta. C) y D) muestran imágenes de revisión 1 año después de la cirugía. C) desplazamiento caudal del lóbulo de la oreja. D) sutura asistida por láser. La calidad de la cicatriz es de buen aspecto.
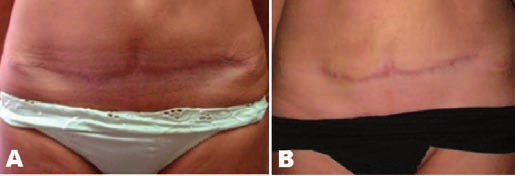
Fig. 7. Dermolipectomía. Paciente de 46 años de edad; imagen 3 meses después de la intervención. A) depresión del tejido en toda la extensión de la incisión y formación de “oreja de perro” en el extremo izquierdo. B) imagen 3 meses después de reintervención de la cicatriz con sutura en dos planos asistida por láser en la totalidad de la línea de la herida. Cicatriz prácticamente imperceptible y buen aspecto de las características y textura de la piel.
Las proteínas HSP70 modulan el proceso de reacción inflamatoria (11) y son necesarias durante la cicatrización (14). De acuerdo a Oberringer y Atalay, su ausencia compromete el proceso reparativo inhibiéndolo o retrasándolo. Consecuentemente, la acción térmica del láser y la selección de los parámetros adecuados, son críticas para obtener el aumento de temperatura óptimo, tal y como describe Capon (15). En el mismo sentido, los trabajos de Jansen han mostrado que el láser induce la presencia de HSP70, particularmente en un rango de temperaturas de entre 45 a 55 ºC (16).
Souil ha observado que la proteína a la que nos referimos se expresa principalmente en la capa superior de la epidermis (10). No obstante, el efecto térmico del láser acrecienta la expresión de la HSP70 induciendo la síntesis de nuevas proteínas detectables en los estratos de la dermis, como consecuencia de la propagación del calor en el tejido durante la irradiación tal y como muestra la identificación de proteínas HSP70, especialmente alrededor de los vasos sanguíneos, de los folículos pilosos y de las glándulas sebáceas (10). La referida respuesta frente al choque térmico y la respuesta a la absorción de la energía láser, serían las responsables del incremento de la presencia de factores de crecimiento y, particularmente, conducirían la modificación del perfil de la expresión de la TGF-ß (17,18).
Otros autores han comunicado que la expresión predominante TGF-ß3, comparativamente a la expresión TGF- ß1 y TGF- ß2, mejora la cicatrización cutánea (19,20); en efecto, la diferencia más significativa entre los tejidos normales y los cicatriciales se considera que está relacionada con la orientación de la matriz del colágeno y/o de la fibrosis que puede producirse en el tejido durante la formación de la cicatriz (21).
En cuanto a la histología, el papel desarrollado por el colágeno I y III según se ha observado en estudios histológicos en pacientes en los que se analizó la presencia de colágeno tipo I y II y fibronectina mediante inmunohistoquímia (como es el caso de nuestro estudio), empleando anticuerpos policlorados anti-colágeno I y anticolágeno de tipo III (2), han revelado que el colágeno tipo I y tipo III analizados por imagen (Leica® Microsystems SAS, Nanterre, Francia) revela cambios en el porcentaje de estos dos colágenos y de la fibronectina, particularmente en la dermis papilar y reticular. Según se ha observado existe una clara disminución en el colágeno I y de la fibronectina en las cicatrices tratadas con láser, en tanto que es el colágeno tipo III el que disminuye en las cicatrices control, no tratadas con láser (22).
El proceso cicatricial patológico, sistemáticamente se asocia a cifras elevadas de colágeno tipo I y III, en tanto que los valores pequeños conducen a regeneración del tejido, bien conocida en la literatura anglosajona como scarless healing process.
Más recientemente, Laubach ha comunicado no haber observado signos de degradación del colágeno tipo II tres meses después del tratamiento láser (23), lo que estaría a favor de la aceleración cicatricial que produce el tratamiento láser.
Una mala cicatrización puede ser invalidante funcional y estéticamente; por tanto, los efectos térmicos del láser inducen, por las características de su luz, la modulación de la respuesta cicatricial.
Conclusiones
La técnica LASH es simple de efectuar, reproducible y rápida, ofrece una clara evidencia de que es posible reducir considerablemente la notoriedad de la cicatriz residual e incluso, en determinados casos, puede conseguirse hacerla prácticamente invisible.
Fuente – Descargar archivo completo; Soldura Cutanea
Autor
Dr. Serge Mordon
INSERM U 703 152, rue du Dr. Yersin 59120
59120 Loos, Francia.
e-mail: serge.mordon@inserm.fr